Senyawaan yang terbentuk dari atom unsur karbon dengan struktur yang berbeda disebutalotrop karbon. Grafit, intan, fullerene dan karbon amorf merupakan contoh dari alotrop karbon yang sejauh ini diketahui.
Dalam tabel peridoik unsur karbon memiliki simbol C dengan nomor atom 6 dan terletak pada golongan 4A atau 14, periode 2 dan termasuk blok p. Konfigurasi elektron atom karbon adalah 1s2 2s2 2p2 atau [He] 2s2 2p2 dengan susunan elektron dalam kulit atomnya adalah 2, 4. Berdasarkan konfigurasi elektronnya diketahui bahwa karbon memiliki 4 elektron valensi. Empat elektron valensi karbon ini dapat digunakan untuk membentuk ikatan kovalen dengan atom lain maupun dengan atom karbon yang lain.
Intan
Intan atau berlian atau diamond merupakan alotrop karbon yang memiliki nilai ekonomi yang tinggi dan hingga saat ini intan dikenal sebagai mineral alami yang paling keras dimana belum ada mineral lain yang berhasil menggores atau memotong intan.
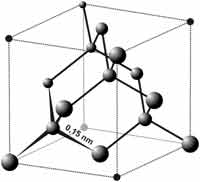
Struktur intan
Sifat dan pemakaian Intan
Berikut beberapa sifat dan pemakaian intan:
- Intan merupakan mineral alami yang paling keras, sehingga intan banyak digunakan sebagai alat untuk memotong, mengasah dan sebagai mata bor.
- Memiliki titik leleh yang sangat tinggi yakni 4827 °C). Hal ini disebabkan Ikatan kovalen karbon-karbon yang terbentuk pada struktur intan sangat kuat bahkan lebih kuat dari ikatan ionik.
- Berupa isolator namun dapat menyerap panas dengan sangat baik. Daya hantar listrik intan berkaitan dengan elektron yang digunakan untuk membentuk ikatan, dimana pada intan elektron-elektron berikatan sangat kuat sehingga tidak ada elektron yang bebas bergerak ketika diberi beda potensial. Sifat penyerap panas yang baik dari intan diaplikasikan pada peralatan elektonik untuk menyerap panas yang dihasilkan ketika peralatan elektronik digunakan. Dengan melapisi intan pada konduktor dalam peralatan elektronik maka suhu peralatan tersebut dapat dijaga relatif konstan sehingga peralatan tersebut dapat berfungsi secara normal.
- Tidak larut dalam air dan pelarut organik. Dalam hal ini tidak memungkinkan terjadinya daya tarik antara molekul pelarut dan atom karbon yang dapat membongkar dayatarik antara atom-atom karbon yang berikatan secara kovalen. Akibat pelarut tidak mampu mensolvasi molekul intan.
Dalam struktur intan setiap atom karbon berikatan secara kovalen dengan atom 4 karbon lain dalam bentuk tetrahedral dan panjang setiap ikatan karbon-karbon adalah 0,154 nm.
Intan kini dapat produksi secara komersial dalam skala laboratorium maupun skala industri. Bahan dasar pembuatan intan yaitu grafit dengan katalis logam. Proses pembuatan intan dari grafit dilakukan pada suhu tinggi yakni sekitar 3500 °C bahkan dapat lebih tinggi dan tekanan tinggi pula yakni sekitar 140.000 atm atau lebih. Selain menggunakan cara tersebut, intan dapat dihasilkan dengan pirolisis hidrokarbon pada suhu relatif rendah (± 900 °C) dan tekanan realtif lebih rendah pula yakni sekitar 102 Pa.
Namun dalam kehidupan sehari-hari intan yang sering dijumpai terdiri dari berbagai macam warna. Berbagai warna yang dihasilkan intan dipengaruhi oleh 3 hal yaitu
- Adanya pengotor dalam struktur intan sehingga pengotor tersebut dapat mengubah spektrum absorbsi intan. Spektrum intan yang berubah akibat adanya pengotor tergantung pada jenis dan konsentrasi pengotor yang ada Misalnya intan kuning dan oranye mengandung nitrogen, intan biru mengandung boron, intan abu-abu, ungu dan hijau mengandung hidrogen.
- Intan hijau disebabkan oleh radiasi alam, yang terjadi selama berjuta-juta tahun sehingga dapat mengubah struktur atom dalam intan. Akibat berubahnya struktur intan menyebabkan sektrum absorpsi intanpun berubah.
- Intan merah muda, merah dan coklat disebabkan oleh adanya deformasi plastik. Struktur atom karbon yang memutar selama pembentukan intan dalam tanah sehingga mengubah sektrum absorpsi intan. Hal ini tampak pada intan sebagai garis urat yang menyerupai urat kayu. Garis inilah yang memberikan spektrum warna yang berbeda.
Grafit
Grafit merupakan alotrop karbon yang dapat menghantarkan arus listrik dan panas dengan baik. Karena sifat inilah grafit biasanya digunakan sebagai elektroda pada sel elektrolisis.
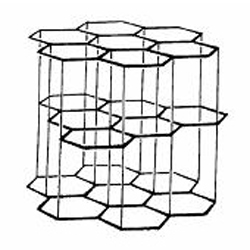
Dalam struktur grafit setiap atom karbon membentuk ikatan kovalen dengan tiga atom karbon lainnya membentuk susunan heksagonal dengan struktur berlapis seperti tumpukan kartu. Karena atom karbon memiliki 4 elektron valensi maka pada setiap atom karbon masih terdapat satu elektron yang belum berikatan (elektron bebas).
Sifat daya hantar listrik yang dimiliki oleh grafit dipengaruhi oleh elektron-elektron yang tidak digunakan untuk membentuk ikatan kovalen. Elektron-elektron ini tersebar secara merata pada setiap atom C karena terjadi tumpang tindih orbital seperti pada ikatan logam yang membentuk awan atau lautan elektron. Oleh sebab itu ketika diberi beda potensial, elektron-elektron yang terdelokaslisasi sebagian besar akan mengalir menuju anoda (kutub positif), aliran elektron inilah yang menyebabkan arus listrik dapat mengalir. Sedangkan ketika salah satu ujung dipanaskan maka elektron-elektron ini akan segera berpindah menuju bagian yang memiliki suhu lebih rendah. Akibatnya panas tersebut akan menyebar ke bagian grafit yang memiliki suhu lebih rendah. Struktur grafit seperti yang tertera pada Gambar.
Ikatan kovalen antar lapisan pada grafit relatif lebih lemah bila dibanding ikatan kovalen antar antar atom dalam satu lapisan. Dengan adanya hal ini menyebabkan grafit bersifat licin, karena lapisan yang berada dibagian atas mudah tergelincir atau mudah tergeser.
Sifat dan Kegunaan Grafit
- Memiliki titik leleh tinggi, sama seperti intan. Hal ini disebabkan iktan kovalen yang terbentuk sangat kuat sehingga diperlukan energi yang tinggi untuk memutuskannya.
- Memiliki sifat lunak, terasa licin dan digunakan pada pensil setelah dicampu tanah liat.
- Tidak larut dalam air dan pelarut organik, karena tidak mampu mensolvasi molekul grafit yang sangat besar.
- Dibanding intan, grafit memiliki massa jenis yang lebih kecil, karena pada strukturnya terdapat ruang-ruang kosong antar lipatannya.
- Berupa konduktor listrik dan panas yang baik. Karena sifat ini grafit digunakan sebagai anoda pada baterai (sel Leclanche) dan sebagai elektroda pada sel elektrolisis.
Fulleren
Fuleren adalah alotrop karbon dimana 1 molekul karbon terdiri dari 60 atom karbon sehingga sering disebut sebagai C60. Pada struktur fulleren setiap atom karbon berikatan dengan tiga atom karbon lain dengan pola membentuk susunan pentagonal membentuk struktur berongga seperti bola sepak. Struktur fulleren seperti yang tertera pada Gambar.
Sifat dan pemakaian
- Tidak larut dalam air, tetapi dapat larut dalam pelarut organik.
- Sebagai superkonduktor dan penyerap panas yang baik. Sifat superkonduktor dan menyerap panas ini berkaitan 1 elektron yang tidak digunakan untuk membentuk ikatan kovalen, seperti pada grafit. Salah satu senyawaan C60 yang merupakan semikonduktor adalah K3C60.